治療藥物監測 ( therapeutic drug monitoring,TDM) 是指在臨床進行藥物治療過程中�����,觀察藥物療效的同時,定時采集患者的體液(如血液����、尿液、唾液等) ����,測定其中的藥物或其代謝產物的濃度����,探討藥物在體內的生物轉化過程以及藥物濃度的安全范圍�����,并以藥動學和藥效學理論為基礎�����,借助先進的分析技術與電子計算機手段,設計最佳給藥方案 (藥物劑量�����、給藥途徑�����、用藥間隔等) ����,實現個體化用藥����。TDM 旨在指導患者合理用藥,以期達到安全����、有效、經濟的用藥目標。大部分臨床藥效指征明顯或毒性小的藥物無需進行 TDM����。目前�����,國內外進行 TDM 的藥物主要有抗生素、抗病毒����、抗腫瘤藥物以及心血管類����、神經精神類和免疫抑制類藥物����。抗腫瘤藥物的治療指數低,毒性相對較大,體內吸收����、分布�����、代謝和排泄過程存在廣泛的個體差異。癌癥患者的治療方案需要不斷改進,聯合用藥種類繁多,治療效果與患者的基礎體征關系密切。因此�����,抗腫瘤藥物在臨床應用時有必要進行治療藥物監測����。本文將從治療藥物監測的研究進展����、抗腫瘤藥物的應用特點以及治療藥物監測在抗腫瘤藥物中的臨床應用 3 個方面進行綜述�����。
傳統的細胞毒類藥物和與分子靶向藥物是當今臨床抗腫瘤藥物治療的主導。然而,臨床上腫瘤患者接受藥物治療的風險依然很高�����。這主要是由于藥物的療效不佳�����、毒性過大以及耐藥性造成的�����。抗腫瘤藥物的特殊性導致了治療藥物監測的必要性。?
首先�����,抗腫瘤藥物的治療指數低����,安全范圍窄,用藥時容易出現藥量不足或過量中毒的現象�����。其次����,血藥濃度與藥效和毒性的相關性強����,藥時曲線下的面積( area under concentration-time curve,AUC) 與穩態血藥濃度 ( steady state plasma concentration�����,Css) 比給藥劑量更能反映藥效和毒性�����。第三����,藥效和毒性不宜直接觀察和甄別�����,比如化療藥物通常需要服用多個周期才能判斷是否有效�����,鉑類藥物的神經毒性具有蓄積作用,且某些抗癌藥物也有致癌作用等�����。第四�����,腫瘤屬于重癥疾病,其給藥方案與患者的心、肝、腎等臟器的功能水平密切相關����,其治療效果將直接決定患者的生存質量甚至預期壽命�����。上述特點表明����,抗腫瘤藥 物需要密切監測并及時調整血藥濃度�����,同時要結合患者自身體征制定個體化的用藥方案�����,TDM無疑將發揮重要作用。
藥物相互作用是指兩種或兩種以上的藥物同時應用時所發生的藥動學和藥效學變化����。藥動學方面�����,某些藥物能調節P-糖蛋白( P-glycoprotein,P-gP) 和細胞色素 P450 酶( cytochrome P450,CYP450) 系統,從而影響其他藥物的吸收�����、分布����、代謝和排泄����。藥效學方面,不同藥物在作用機制上存在相加、協同或拮抗,從而影響藥效或毒性�����。腫瘤患者的用藥往往有多種�����,這主要是由于: ① 抗腫瘤藥物的給藥方案經常涉及多藥聯合�����。② 抗腫瘤藥物的毒副作用較大,需要同時服用其他藥物進行調節����。③ 腫瘤患者的其他基礎病也需要服用藥物�����。研究發現,60% 左右的腫瘤患者至少存在一種以上的基礎疾病以及一次以上的藥物相互作用風險�����。因此�����,制定腫瘤患者的給藥方案要充分考慮到患者和藥物等個體化因素,并且根據 TDM 的結果隨時調整方案�����。腫瘤患者往往還需服用精神類����、心血管類、抗生素類����、鎮痛類以及抗凝類藥物�����,抗腫瘤藥物與這些藥物的相互作用詳見表 1�����。

TDM?的臨床應用主要建立在藥物的藥效學和藥動學研究基礎之上����。因而�����,在臨床上尋找抗腫瘤藥物的適宜的藥動學參數范圍就顯得尤為重要�����。報道顯示,甲氨蝶呤����、氟尿嘧啶類�����、紫杉醇和伊馬替尼等抗腫瘤藥物的藥動學和藥效學關系已經比較明確,臨床 TDM 也比較成熟�����,可以用于指導臨床用藥�����。同時����,其他藥物的 TDM 還有待進一步研究����。?
甲氨蝶呤( methotrexate�����,MTX)
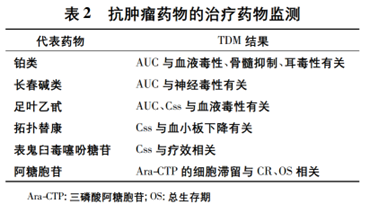
MTX 的治療指數較低����,患者用藥時藥效與毒性反應容易同時出現����。大劑量使用 MTX 時需配合甲酰四氫葉酸鈣 ( calcium folinate,CF) 解救療法,CF 解救劑量和時間應依據患者 MTX 血藥濃度而定�����。研究表明�����,當 MTX 的血藥濃度在給藥后 24 h 仍高于5 μmol·L-1或給藥后 48 h 仍高于0.5 μmol·L-1時�����,應給予 CF 解救����。
氟尿嘧啶類( fluorouracil�����,5-Fu)
眾所周知,雙氫嘧啶脫氫酶( dihydropyrimidine dehydrogenase,DPD酶) 的活性可影響 5-Fu 的代謝。但由于不能準確預測毒性����,故 DPD 酶只能作為參考����。報道顯示�����,5-Fu 的毒性與血藥濃度�����、AUC均關系密切: 當給藥 5 d 后,若血藥濃度大于 1.5 μmol·L-1�����,則患者白細胞明顯降低; 一個治療周期結束后����,當 AUC 達到30 mg·L-1?·h-1時,5-Fu 的毒性明顯,而當 AUC 達到 29 mg·L-1?·h-1時患者的壽命則能延長?����?ㄅ嗨麨I( capecitabine) 在體內代謝為 5-Fu�����,故卡培他濱的毒性也與血藥濃度密切相關。
紫杉醇( paclitaxel����,Taxol)
紫杉醇是治療婦科腫瘤的常用藥物����。臨床證實�����,Taxol 治療卵巢癌時�����,其血藥濃度大于 0.05 μmol·L-1?的時程與腫瘤完全緩解( complete response,CR) 或部分緩解( partial response�����,PR) 的比例以及無進展生存期( progression-free survival����,PFS) 成正相關; 作為 Taxol 常見的血液毒性,中性粒細胞減少的百分比與血藥濃度大于 0.1 μmol·L-1?的時程顯著相關; Taxol 聯用表阿霉素后����,其血藥濃度大于 0.1 μmol·L-1?的時間會相應減少�����,毒副作用也相應下降����。
伊立替康( irinotecan�����,CPT-11)
伊立替康是喜樹堿類似物,它在體內轉化為有活性的 SN-38 后發揮抗癌作用�����,但同時也會伴有嚴重的血液毒性����。活性 SN-38 通過肝臟 UGT1A1 轉化為無活性的 SN38G�����,故 UGT1A1 的多態性會引起 SN-38 水平的變化�����。在臨床用藥時����,通過檢測 UGT1A1 的基因型以及 SN-38 的水平可以及時預測并發現與 CPT-11 相關的毒副作用�����。
伊馬替尼是用于治療慢性髓性白血病 ( chronic myelognous leukemia����,CML) 和惡性胃腸道間質腫瘤( gastrointestinal stromal tumor����,GIST) 的常用靶向藥物����。研究發現,伊馬替尼的臨床療效主要與其谷濃度密切相關����。在 CML 的治療中�����,伊馬替尼谷濃度達到1170 ng·mL-1可以獲得更好的治療效果,但肌痛、皮疹�����、貧血和液體潴留的發生率也較高; 在 GIST 的治療中����,伊馬替尼谷濃度達到 1110 ng·mL-1可以獲得更長的 PFS。此外,針對其他抗腫瘤藥物也已開展一系列 TDM 研究(見表 2)
由此可見,與經典藥理學和分子生物學方法相比,TDM通過及時觀測患者的血藥濃度(如坪濃度����、峰濃度、谷濃度以及AUC等) �����,能更早為患者判斷是否存在治療失敗����、療效不佳或過量中毒的風險。國外一篇研究 GIST 治療的文獻顯示,醫生為 GIST 患者選擇靶向藥物的過程分為 6 步: 疾病診斷、分期 分型�����、實施給藥�����、濃度監測����、療效評價以及藥物調整����, 這與前文提到的治療藥物監測 7 步操作流程基本一致。
合理用藥是指以藥物和疾病的系統知識和理論為基礎����,安全�����、有效�����、經濟�����、適當地為患者使用藥物,以達到治療�����、診斷和預防疾病的目的�����。WHO 發布的公告稱�����,全球仍有 50% 的患者未能正確的使用藥物。在我國����,患者用藥的種類����、劑量����、方式及配伍不當的現象還比較嚴重,因而導致療效未達預期����、不良反應和耐藥性普遍發生。要想做到合理用藥����,除了需要嚴格遵守規章制度����、全面掌握藥品信息外,還必須充分考慮到患者的個體差異�����,通過治療藥物檢測及時優化給藥方案�����。前文提及的幾類藥物就是抗腫瘤藥物合理應用的有力明證�����,但臨床實踐表明更廣泛的研究還有待進一步展開。TDM 的前提條件是明確的量效(毒)關系����,即建立血藥濃度(或 AUC����、峰谷濃度) 與療效����、毒性之間的關系。TDM?可以發現患者血藥濃度的個體化差異����,而藥物基因組學可以預測患者的療效和毒性,兩者的有機結合是指導臨床用藥的前提保障(詳見圖 2) 。然而����,TDM在實際應用中也遇到一些困難����。首先�����,抗腫瘤藥物需在體內轉化為活性代謝物才能發揮作用����,而血液中的活性代謝物比原型藥物更難監測�����。其次����,腫瘤組織中血管異常增生����、血供特殊,體循環中監測到的血藥濃度未必能真實反映腫瘤組織中的藥物分布�����。再次�����,抗腫瘤藥物的監測時程長,若用治愈率作為療效評價標準�����,或者觀察藥物蓄積毒性����,均需隨訪多年才能得到完整數據。第四�����,腫瘤治療多采用聯合給藥,監測時難以區分單藥的療效及毒性�����,同時還要考慮藥物的相互作用����。最后,為了避免藥物在患者體內產生毒性或抗藥性�����,臨床應用抗腫瘤藥物時多采取間歇給藥����,有時難以達到穩態血藥濃度,從而給監測帶來困難。
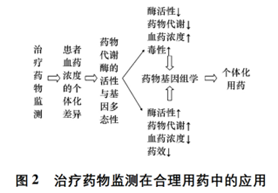
綜上所述����,由于抗腫瘤藥物以及腫瘤患者的特殊性,TDM 在制訂個體化用藥方案的過程中發揮了重要作用�����,同時也面臨嚴峻挑戰�����。目前�����,國內的TDM研究還更多停留在理論層面,臨床實踐較少�����。只有在加強理論研究的基礎上�����,不斷深入臨床實踐�����,積累患者用藥證據����,并且與藥物基因組學有機結合,才能切實做到為用藥患者“量體裁衣”,保證抗腫瘤藥物的合理使用�����。
1�����、采血時間點:一般為 24 小時�����,48 小時和 72 小時�����,但 24 小時給藥方案 的初始采血點為給藥結束后 36 小時或開始給藥后 42 小時。?
2�����、監測頻率:正常代謝患者的監測頻率為 3 次或 4 次�����;代謝延遲患者的監 測頻率根據 MTX 的血藥濃度����,直到 MTX<0.1umol/L 即可停止監測����。
1�����、采血時間點:采血時間為氟尿嘧啶靜脈滴注開始后(24±6)小時�����,并應 準確記錄靜脈滴注開始,結束及采血時間。
2����、監測頻率:給藥后監測 1 次(AUC)�����。
1����、采血時間點:靜脈輸注后(24±6)小時����。?
2����、監測頻率:每個化療周期輸液時監測����,以便于調整下一周期的劑量�����。
[1] 李潤娥.抗腫瘤藥物的治療監測[J].臨床合理用藥,2014���,7( 1) : 150 - 151.
[2] 錢新華,張能芳��,高凌.抗腫瘤藥物的治療監測[J].江蘇藥學與臨床研究��,2003��,11( 6) : 36 - 39.
[3] 蘭靜.治療藥物監測的概況及研究進展[J].天津藥學,2010��,22( 3) : 53 - 55.
[4] 魏新.治療藥物監測的方法學研究進展[J].安徽衛生職業技術學院學報���,2010���,9( 1) : 86 - 87���,91.
[5] 謝吉科��,姜德春.治療藥物監測的研究進展[J].中國藥物應用與監測,2011���,8( 6) : 379 - 382.
[6] GER RITSEN-VAN SCHIEVEEN P,ROYER B. Level of evidence for therapeutic drug monitoring of taxanes[J].Fundam Clin Pharmacol��,2011���,25( 4) : 414 -424.